

拉曼效应最早是在20世纪20年代由拉曼C.V发现的。它是一种广泛用于测定分子振动模式的光谱方法。与其他分析化学方法相比,光谱
方法提供高空间分辨率,不需要直接接触来获取化学信息。振动光谱提供了合理的化学特殊性,不需要额外的标记物。而自发拉曼光谱
学是一个弱散射过程。成像和显微镜的应用,一个单一的视野可能要花费数小时的信号积分时间。因此,相干拉曼散射方法,如受激拉
曼散射效应, 现在广泛应用于拉曼成像中。在本应用中, 我们将描述Moku:Lab的锁相放大器是如何在波士顿大学先进的受激拉曼成像
装置中实现的。
介绍
拉曼光谱法是一种非破坏性分析化学方法。它直接探测样品的振动模式。与电子光谱法相比,拉曼光谱法无需荧光标记即可提供高化学
特异性。可以完全无接触和无标签的方式测试样品,从而防止对系统的干扰。红外光谱是获得振动光谱的另一种常用方法。红外光谱和
拉曼光谱的选择规则是不同的。红外光谱对偶极子的变化很敏感,而拉曼光谱对极化率的变化敏感。这使得IR和拉曼成为用于特定化学
键组的良好工具。对于成像和显微镜应用,在红外或拉曼光谱之间进行选择时,还要考虑两个其他重要因素:1)空间分辨率需求。红
外光谱法使用红外光作为光源。拉曼可以使用可见光或近红外(NIR)激光器进行激发。由于可见光或NIR激光的波长要很短,因此拉
曼显微镜的空间分辨率可以达到亚微米范围。另一方面,IR光具有几微米的波长。对于许多显微镜应用来说,空间分辨率被认为是差
的。 2)水在红外区域具有很强的吸收能力。对于富含水的环境(例如生物样品),IR可能遭受强烈的吸收,因此在某些情况下首选拉
曼。
与占主导地位的瑞利散射相比,拉曼散射非常弱。 为了获得合理的信噪比,通常需要几秒钟的长积分时间。 对于常规光谱来说,这可
能不是问题,但是对于光谱成像而言,可能需要几个小时才能获得一个单一的视野。为了增强信号,这些年来已经开发了几种不同的方
法。基于等离激元的方法,例如表面增强拉曼光谱,进一步将检测极限降低到单分子水平。相反,纳米颗粒诱导的不均匀性使其难以成
像。 对于成像科学家来说,更有前景的方法是增强非线性光学的相干拉曼散射方法:受激拉曼散射(SRS)和相干反斯托克斯拉曼散
射(CARS)。
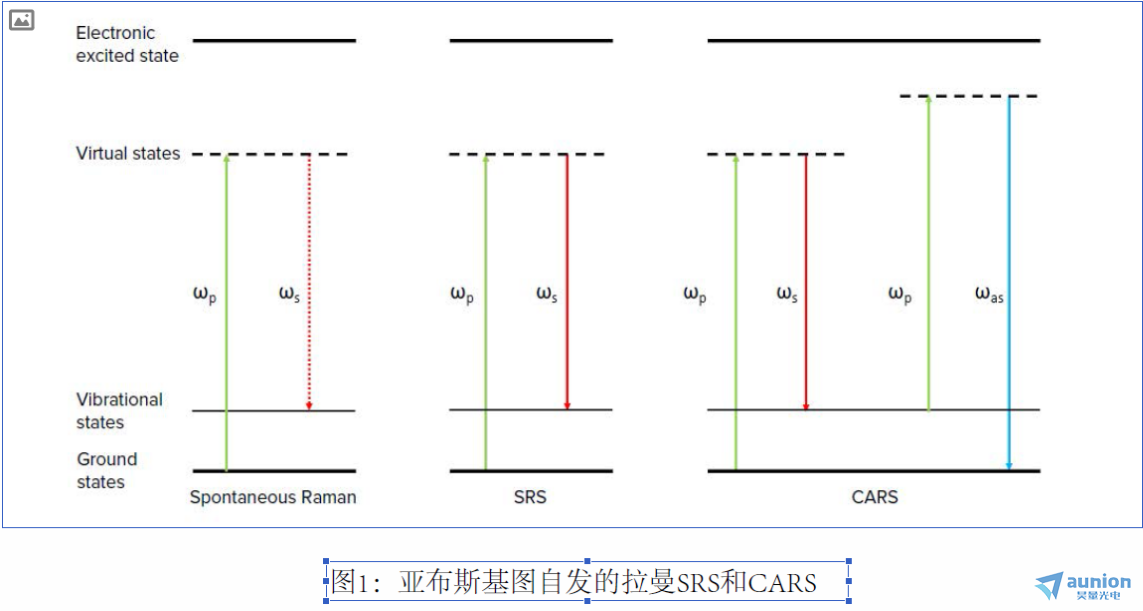
相干拉曼效应最早是在1960年代发现的。在1990和2000年代末,由于超快锁模激光器的进步,谢尼(Sunney Xie)及其同事率先将
CARS9和SRS10用于无标记化学显微镜。从那时起,这些技术已广泛用于化学,生物学和材料科学研究。 CARS和SRS有很多相似之
处。这些非线性光学过程通常在相同条件下发生,并且仪器设置几乎相同。但是,有一些差异。就像自发的拉曼一样,CARS信号(图
1中的ω为反斯托克斯)与入射光束(ωp,泵浦,ωs斯托克斯)的波长不同,使用短通滤波器很容易将信号从入射光中分离出来。
到达检测器的光子总量很小,因此使用更灵敏的光子检测器(例如光电倍增管(PMT))进行检测。但是,CARS受其他非共振非线性
光学效应所产生的背景的影响。 这些影响不仅限制了CARS测量的实际检测极限,而且使光谱失真(与分子振动共振相比)。 另一方
面,SRS信号不受大多数其他非线性光学效应的干扰。 但是,SRS是受激发射过程。 信号以入射光相同的波长发生。 SRS效应仅略微
增加/减少了斯托克斯束和泵浦束的光子数量。 这些变化很小,以至于无法通过常规的时域测量方法进行测量。 因此,SRS需要具有锁
相检测功能的光泵浦探测技术。
光学泵浦探测技术和锁定检测:
泵浦探针法是用于多光子检测过程的一种普遍采用的方法。该实验通常涉及两束超快(皮秒或飞秒)激光束,一束光一直照, 而第二束光
束以恒定频率进行AM调制。因此,由第二束引起的变化或扰动都会以调制频率被传递到第一束。在探测器上, 用一个光学滤波器来阻
挡已调制的光束。仅检测到未调制的波长。作为信号仅发生在调制频率附近,通常使用锁相放大器(LIA)来放大信号。锁相放大器使
用零差检测方法,将输入信号与正弦波本振混合在一起再调制频率。随后,它通过低通滤波器和电压放大器(可选)发送信号,并输出
到数字化仪或示波器。这样可以确保仅放大和检测与调制频率非常接近的信号。拒绝其他频率的信号(例如激光重复频率或DC 背
景)。这使得锁相放大器成为检测泵浦探头的必不可少的工具,可以在一下视频中找到相关锁相放大器的更多详细说明:
https://youtu:.be/H2O2ADqEkHM 和 https://youtu.be/M0Q91_ns2Cg.
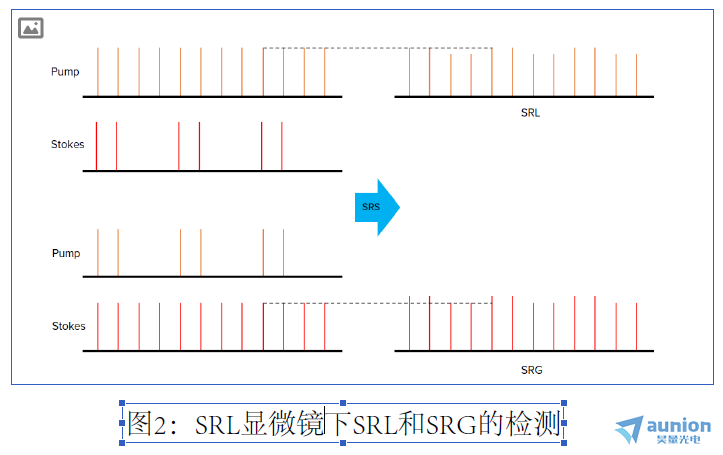
特别是对于SRS,两个光束(泵浦和斯托克斯)的能量差与目标拉曼位移精确匹配。理论上, 泵浦或斯托克斯都可以调制,而另一束用
于检测。如果对泵浦光束调制,则在泵浦光束处于开启状态时,SRS过程会导致斯托克斯光束稍微增加。在检测中,泵浦光束被阻挡
,仅斯托克斯光束被检测到。这被称为受激拉曼增益(SRG)检测。如果斯托克斯束被调制,则在斯托克斯束接通的情况下,SRS过程会
导致泵浦光束略微减小。在探测器处,斯托克斯光束被阻挡,并且只有泵束被检测到。这称为受激拉曼损耗(SRL)检测。对于本应用
笔记中提供的示例用例,由于将光检测器针对泵浦波长进行了优化,因此实施了SRL方案。
实验设置
激光
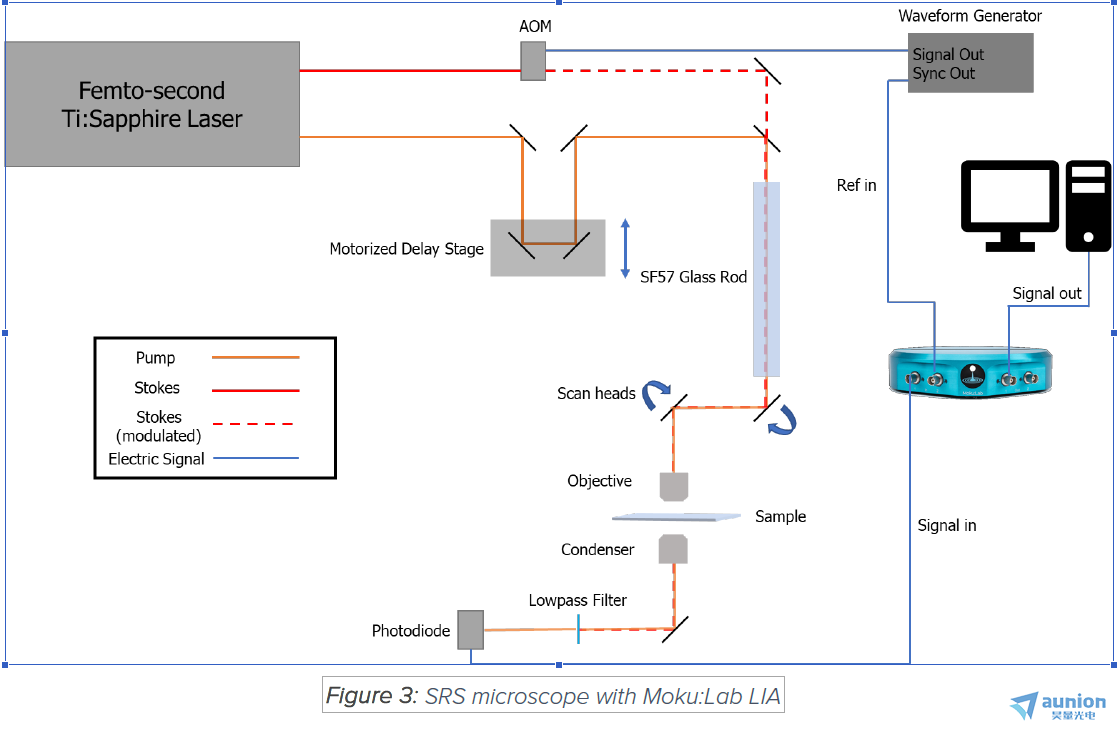
SRS的产生需要两个超快激光脉冲在样品上空间和时间上重叠。为了获得稳定的时间重叠,当今的SRS显微镜通常使用单个Ti:蓝宝石
激光可产生泵浦光束和斯托克斯光束。皮秒和飞秒激光器均可用于SRS测量。皮秒激光器提供了更精细的光谱轮廓。无需额外的光学器
件即可实现高光谱分辨率。与自发拉曼光谱不同,自发拉曼光谱可以用单色激光同时测量所有拉曼光谱,而受激拉曼光谱则需要进行波
长调整以测量其他光谱点,并且在获取光谱图像时调整激光波长会限制测量速率。另一方面,飞秒激光器本身具有广谱。可以使用一种
称为“光谱聚焦”的技术来快速调整泵和斯托克斯束之间的能量差。可以在更短的时间内获取光谱图像。但是,这种方法增加了系统的
光学复杂性。需要在光束路径中添加一对衍射光栅或高折射率材料(例如SF57玻璃棒),让光谱范围受到限制。有关频谱聚焦方法的
详细说明可以在最近的出版物中找到。
简而言之,如果一次关注单个拉曼位移,则皮秒激光的设置要简单得多。飞秒激光器是快速高光谱图像采集的首选,但系统比较复杂
性。 Moku:Lab LIA可以与皮秒和飞秒激光器配对使用。在本文中介绍的用例中,飞秒激光器(Spectra-physics Mai Tai)与SF57
玻璃棒一起用于光谱聚焦。
调制,延迟阶段和扫描:
泵浦和斯托克斯束通常由声光调制器(AOM)或电光调制器(EOM)进行调制。调制频率通常在MHz范围内。这有助于减少由光热
膨胀产生的背景并提高图像采集速度。在本应用笔记中,泵浦光束是由AOM在2 MHz左右调制的。为了使泵浦和斯托克斯光束在时间
上保持一致,一个电动的延迟用于调整任一或两个光路驱动器的光路长度。
对于具有光谱聚焦的飞秒SRS,延迟级还用于微调泵浦和斯托克斯束之间的能量差。
像大多数其他非线性光学显微镜一样,光束扫描方法通常用于CARS和SRS图像采集。在物镜之前放置一对振镜或振镜扫描头。在本例中,使用了一对振镜(GVS 102,Thorlabs)。
物镜/聚光镜,探测器和数据采集
在扫描头后,将光束导向物镜以在样品上形成一个紧密聚焦的点。为了建立相干拉曼散射的相位匹配条件,最好使用高数值孔径
(NA)的水或油浸物镜。然后沿向前方向收集光,将其重新聚焦到光电探测器上。确保收集效率,建议使用油浸物镜。在本例中,使用
的是60X 1.2 NA水浸物镜(UPLSASP 60XW,Olympus)。
一旦聚光器收集到光,然后将其重新聚焦到光学滤镜之后的光电二极管上,以阻挡调制光束。然后,将来自光电二极管的信号发送到锁
相放大器上(取决于光电二极管的配置,可能需要前置放大器/跨阻放大器)。锁相放大器将信号与本地振荡器混合,然后将调制频率
的交流信号转换为直流输出。然后将其发送到数据采集系统以形成图像。在此应用中,将Hamamatsu S3994-01与自制的跨阻放大器
配对使用,以检测滤光器之后的剩光。然后将信号发送到Moku:Lab的LIA,以进行交流信号放大和对话。使用外部(PLL)模式对输
入进行了解调。混频器之后使用了一个7μs二阶低通滤波器。然后,在10 dB增益之后,将解调后的信号发送到模拟输出。 LIA的输出
由NI DAQ系统数字化,图像由家用NI虚拟仪器生成。
结果和讨论
为了测试Moku:Lab的LIA性能,将一滴二甲亚砜(DMSO)夹在两个盖玻片之间。 然后通过SRS显微镜对液滴的边缘成像。 在扫描
头之前,用798 nm泵浦(30 mW)和1 040 nm Stokes(1 50 mW)调谐激光器。在整个光谱范围内总共采集了1 00张图像。LIA的
时间常数设置为7μs。图4示出了液滴边缘的X-Y轮廓,并且在右侧绘制了Z轮廓(拉曼光谱)。 可以清楚地观察到由C-H键振动共振引
起的两个主峰。
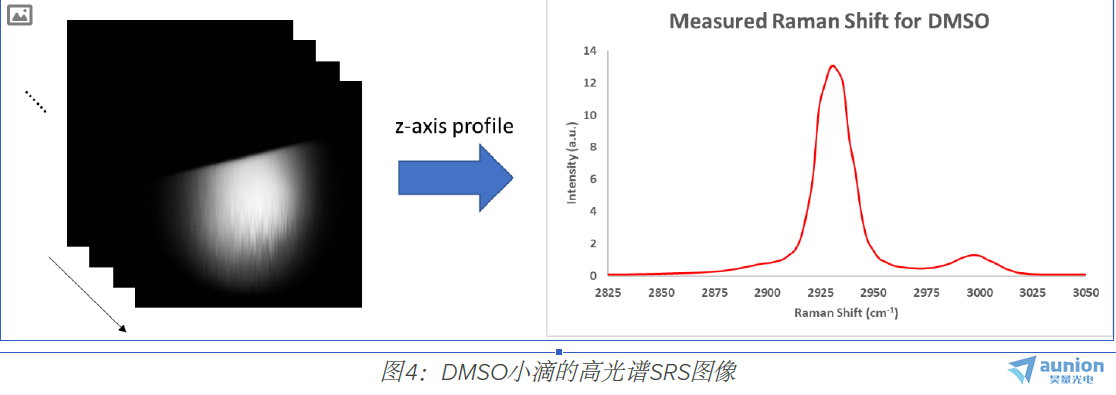
要访问图像的信噪比(SNR),请使用最亮的图像(2930 cm-1附近)。 信噪比(SNR)由液滴区域中10×10框的平均强度超过背景
区域10×10框的标准偏差计算得出。观察信SNR为1100。
参考文献 :
1. Raman, C. V. (1922). The molecular scattering of light. University of Calcutta.
2. Raman, C. V. (1928). A new radiation.
3. Long, D. A. (1977). Raman spectroscopy. New York, 1-12.
4. Colthup, N. (2012). Introduction to infrared and Raman spectroscopy. Elsevier.
5. Zhang, S., Song, Z., Godaliyadda, G. D. P., Ye, D. H., Chowdhury, A. U., Sengupta, A., … & Simpson, G. J. (2018). Dynamic sparse sampling for confocal Raman microscopy. Analytical chemistry, 90(7), 4461-4469.
6. Prince, R. C., Frontiera, R. R., & Potma, E. O. (2017). Stimulated Raman scattering: from bulk to nano. Chemical reviews, 117(7), 5070-5094.
7. Zhang, C., & Cheng, J. X. (2018). Perspective: Coherent Raman scattering microscopy, the future is bright. APL Photonics, 3(9), 090901.
8. Nie, S., & Emory, S. R. (1997). Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science, 275(5303), 1102-1106.
9. Zumbusch, A., Holtom, G. R., & Xie, X. S. (1999). Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical review letters, 82(20), 4142.
10. Freudiger, C. W., Min, W., Saar, B. G., Lu, S., Holtom, G. R., He, C., ... & Xie, X. S. (2008). Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science, 322(5909), 1857-1861.
11. Cheng, J. X., & Xie, X. S. (Eds.). (2016). Coherent Raman scattering microscopy. CRC press.
12. Liao, C. S., Huang, K. C., Hong, W., Chen, A. J., Karanja, C., Wang, P., ... & Cheng, J. X. (2016). Stimulated Raman spectroscopic imaging by microsecond delay-line tuning. Optica, 3(12), 1377-1380.
您可以通过我们的官方网站了解更多的产品信息,或直接来电咨询4006-888-532。

