

高精度压电纳米位移台作为原子力显微镜(AFM)的核心定位系统,为生物纳米研究提供了革命性的技术支撑。本文系统介绍了压电纳米位移台与AFM的协同工作机制,重点阐述了其在生物领域的五大关键应用:高分辨率生物分子成像、单分子力学测量、活细胞动态观测、纳米操纵与分子组装以及生物传感器开发。文章还提供了针对不同生物研究场景的选型方案,并展望了该技术在单细胞诊疗和纳米机器人等前沿领域的应用前景。
昊量光电推出“PIEZOCONCEPT”公司高精度单轴、双轴、三轴以及多轴纳米级位移压电位移台、物镜扫描台、快反镜系列产品与原子力显微镜(AFM)的结合在生物领域的应用主要集中在高分辨率成像、纳米操纵、单分子力学测量以及动态生物过程观测等方面。通过典型研究案例(如F₁-ATPase旋转机制观测、活细胞弹性模量检测、核小体动态行为解析等)和实测数据,论证了PIEZOCONCEPT系列位移台在亚纳米定位精度(0.005nm)、高速响应(12500Hz)和环境适应性等方面的技术优势。
展示全部 
高精度压电纳米位移台:AFM显微镜的精密导航系统
——为生物纳米研究提供定位解决方案
在原子力显微镜(AFM)研究中,您是否常被这些问题困扰?
→ 样品定位耗时过长,错过关键动态过程?
→ 扫描图像漂移失真,数据重复性差?
→ 传统位移台精度不足,无法满足纳米级研究需求?
高精度压电纳米位移台正是解决这些痛点的答案——它如同AFM的‘超精密导航系统’,让纳米探索稳、准、快!"
在生物领域,压电位移台(Piezoelectric Stage)与原子力显微镜(AFM)的结合形成了“高精度定位”与“纳米级探测”的协同关系,显著提升了AFM在生物样本成像、力学测量和动态过程研究中的能力。
压电位移台与原子力显微镜(AFM)的结合在生物领域的应用主要集中在高分辨率成像、纳米操纵、单分子力学测量以及动态生物过程观测等方面。
1. 高分辨率生物分子成像
案例:DNA和蛋白质的高清形貌扫描
压电位移台提供稳定的纳米级定位,使AFM能够对生物大分子(如DNA、蛋白质、膜蛋白)进行高分辨率成像。
名古屋大学生物原子力探针前沿研究中心[1],利用高速AFM(HS-AFM)结合压电扫描台,实时观察F₁-ATPase酶的旋转催化作用,时间分辨率达毫秒级。
加州大学生物科学系[2],在早期AFM研究,使用压电位移台在液体环境中对DNA进行高分辨率成像。
2. 单分子力学测量(力谱分析)
案例:蛋白质折叠、细胞力学特性测量
压电位移台可精确控制探针-样品距离,用于测量生物分子的力学特性(如弹性、粘附力、结合力)。
Keir[3]等人利用AFM结合压电位移台在单分子力学测量中的应用,如蛋白质去折叠、DNA拉伸等。
哥伦比亚大学生物科学系Lewyn Li等人[4]利用AFM力谱技术结合压电位移台,研究纤维连接蛋白(fibronectin)的机械去折叠过程。
长春理工大学王作斌老师[5]团队研究使用原子力显微镜(AFM)对细胞进行形态学和生物力学特性分析,观察全氟醇处理对细胞形态和弹性模量的影响。
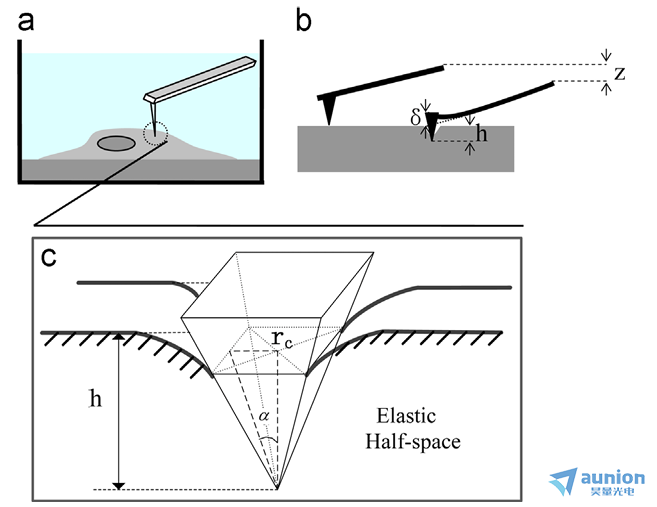
数据图片来源于王作斌老师[5]文章AFM-based study of fullerenol (C60(OH)24)-induced changes of elasticity in living SMCC-7721 cells
压电纳米位移台在活细胞弹性模量测量实验中发挥了关键作用。在测量活细胞的力 - 位移曲线时,实验装置里样品台是固定的,压电纳米位移台会带动AFM(原子力显微镜)探针在z方向朝着样品台移动,以此来实现扫描和压痕功能。在压痕过程中,AFM探针作为压头,通过压电位移台的移动施加压痕力到柔性悬臂上,从而完成对活细胞的压痕操作,进而获取相关数据用于计算活细胞的弹性模量。
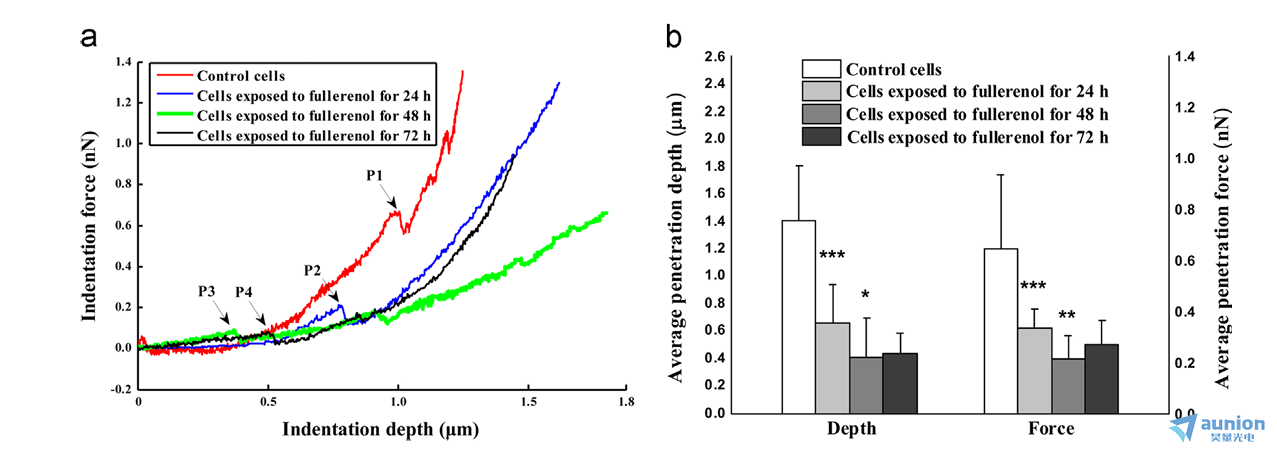
数据图片来源于王作斌老师[5]文章AFM-based study of fullerenol (C60(OH)24)-induced changes of elasticity in living SMCC-7721 cells
3. 活细胞动态观测
案例:细菌运动、细胞膜动态变化
高速压电位移台使AFM能在液体环境中实时观测活细胞的动态行为,如细菌游动、细胞膜重塑等。
Shin Morioka等研究人员[6]使用HS-AFM技术观察了无N-末端尾的核小体在单分子水平上的动态行为。具体来说,他们研究了无尾核小体在滑动和DNA解旋/缠绕过程中的变化,并比较了无尾核小体与野生型核小体的差异。
在研究过程中结合高速AFM和压电位移台,观测活细胞内肌动蛋白(actin)的动态重组过程。HS-AFM是一种能够在液体环境下进行超快速动态成像的技术,具有纳米级别的分辨率,特别适用于生物大分子互作的动态观测。通过HS-AFM,研究人员能够实时观察肌动蛋白骨架的组装和拆卸过程,以及其在细胞内的动态行为。
同时,Fantner GE,Barbero[7]等人利用高速AFM观测细菌(如大肠杆菌)在表面的运动行为。
HS-AFM技术特点
HS-AFM突破了传统原子力显微镜扫描成像速度慢的限制,能够在液体环境下进行超快速动态成像,分辨率达到纳米水平。其探针小且悬臂探针共振频率高,避免了对生物样品的损伤,特别适用于生物大分子互作的动态观测。HS-AFM的扫描速度可达20帧/秒,XY轴分辨率为2纳米,Z轴分辨率为0.5纳米。
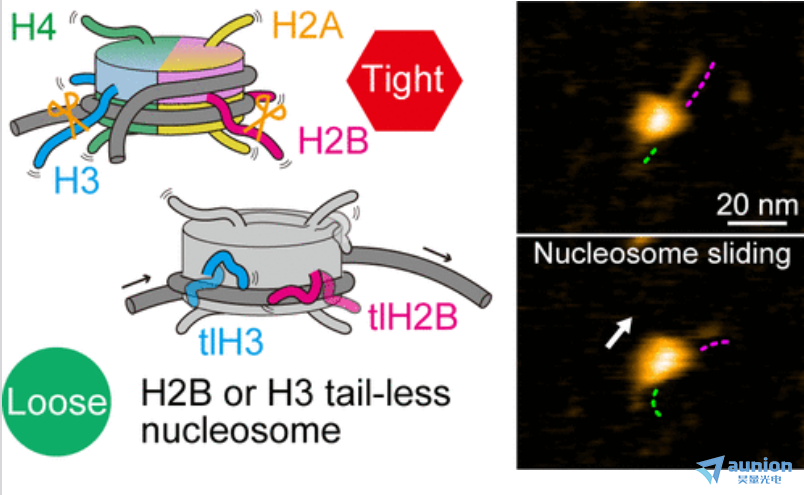
图片来源于Shin Morioka[6]团队High-Speed Atomic Force Microscopy Reveals the Nucleosome Sliding and DNA Unwrapping/Wrapping Dynamics of Tail-less Nucleosomes
4. 纳米操纵与生物分子组装
案例:DNA纳米结构组装、分子操纵
压电位移台可精确控制AFM探针进行纳米操纵,如推动DNA分子、构建纳米结构等。
中国科学院上海核研究所与萨朗大学[8]利用扫描力显微镜对单个生物分子进行操纵,对单个DNA分子进行操纵以及基于单分子操纵和结构表征的一些可能的应用。其中利用AFM探针和压电位移台对单个DNA分子进行切割、折叠和定位。AFM[9]在生物分子操纵中的应用还有如病毒颗粒的移动、蛋白质分子的排列等。
5. 生物传感器与分子识别
案例:抗原-抗体相互作用、分子识别力测量
压电位移台可用于高精度力曲线测量,研究分子间特异性结合(如抗体-抗原、受体-配体)。相关研究[10-11]如AFM力谱对分子相互作用的研究如细胞粘附、药物靶点检测;测量单个抗体-抗原对的结合力,研究免疫识别机制。
压电位移台与AFM的结合在生物领域的关键应用包括:
✅ 高分辨率成像(DNA、蛋白质、细胞膜)
✅ 单分子力学测量(蛋白质去折叠、细胞力学)
✅ 活细胞动态观测(细菌运动、细胞骨架变化)
✅ 纳米操纵(DNA折叠、分子组装)
✅ 分子识别(抗原-抗体、受体-配体相互作用)
这些研究推动了生物物理学、纳米医学和分子生物学的发展。
昊量光电推出“PIEZOCONCEPT”公司高精度纳米级压电位移平台系列产品,它的产品如同AFM的‘超精密导航系统’,让纳米探索稳、准、快!"
下面对“PIEZOCONCEPT”在生物领域产品进行详细的介绍:
1.PIEZOCONCEPT单轴位移平台
PIEZOCONCEPT单轴位移平台产品是可以在单个维度上提供精确定位的产品,主要包含Z轴压电平台、物镜扫描台。其中Z轴位移台Z-INSERT的美妙之处在于它适合每个标准的160mm x 110mm开口(k型框架)。兼容ASI、Marzhauzer、Prior、Ludl 、Zeiss、Nikon、Olympus、Leica等所有品牌。
Z-INSERT还与大多数顶部安装的孵化室(Digital Pixel, Tokai Hit, Okolab)兼容。

Z轴产品图片
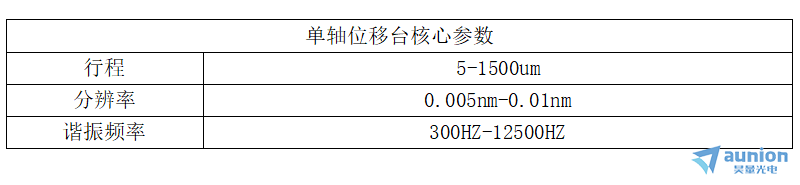
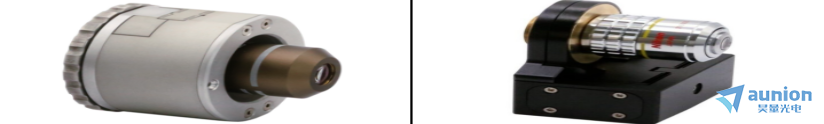
一维扫描平台

2.XY两轴位移平台/XYZ三轴位移平台
两轴压电平台可以提供两个维度上的平移或偏转,主要包括XY二维压电纳米位移台

XY轴压电平台

XYZ轴压电平台
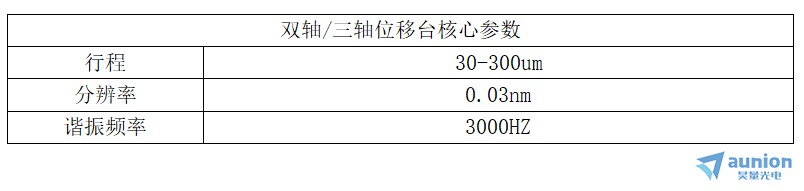
3.多轴位移台
|
|
五轴位移台核心参数 行程100✖100✖100um (X, Y, Z, Theta(X), Theta(Y)) 1.1✖1.5mrad 2.3✖3.0mrad 3.5✖4.5mrad | 六轴位移台核心参数 行程100-300um (X, Y, Z, Theta(X), Theta(Y), Theta(Z)). 1.1✖1.5✖5mrad 2.3✖3.0✖5mrad 3.5✖4.5✖5mrad |
4. PIEZOCONCEPT位移台独特优势
昊量光电推出“PIEZOCONCEPT”高精度单轴、双轴、三轴以及多轴纳米级压电位移台、物镜扫描台、快反镜系列产品;该压电平台以压电陶瓷为驱动,采用了柔性铰链连接的方法,具备精确导向性、高稳定性、高抗疲劳性的特点,同时搭配高精度硅基位移传感器、16Bit高分辨率高速控制器,具有高响应速度,亚纳米级的分辨率,超低底噪(10-50pm)和超高线性度(0.02%),广泛应用于高精密位移领域,包括但不局限于半导体领域。
5.压电位移台在AFM检测中的优点:
1.高精度定位:压电陶瓷的纳米级分辨率(亚纳米级)可实现AFM探针的精确操控,适用于原子级表面形貌扫描。
2.快速响应:高频响应的压电驱动器支持动态模式(如轻敲模式或高速AFM),减少图像失真。
3.闭环控制:集成传感器的闭环压电位移台可补偿蠕变和迟滞,提升扫描准确性。
结合使用的典型场景
(1)大范围扫描与高分辨率成像
多尺度成像:例如在生物检测中,先快速定位感兴趣区域,再进行纳米级细节扫描。
(2)三维纳米操纵与力谱测量
精准力控:压电位移台控制样品与探针的相对位置,实现单分子/单细胞的力学特性测量(如弹性模量、粘附力)。
动态力曲线:通过压电台的快速Z轴位移,实现高频力曲线采集,研究生物分子间相互作用。
(3)原位实验与环境控制
高温/低温AFM:压电台的耐温稳定性支持ji端环境下的样品定位与扫描。
当AFM遇见PIEZOCONCEPT,纳米生物研究将不再受限于设备的物理边界。我们提供的不仅是位移台,更是打开生命微观奥秘的精准钥匙,详情请咨询昊量光电https://www.auniontech.com/details-661.html
关于生产商:

法国PIEZOCONCEPT压电纳米平移台
PIEZOCONCEPT是纳米压电位移平台的供应商,产品应用包括但不限于超分辨率显微镜、光学捕获和原子力显微镜。产品已被顶尖高校和从事前沿研究的科学家使用。
多年来,电容式传感器一直占据着市场主导地位。不幸的是,这项技术显示出了一些局限性。为了满足现代显微镜技术对分辨率的更高要求,PIEZOCONCEPT自行创建了一种实现更大稳定性和线性度的新方法。
PIEZOCONCEPT的目标是找到一个优雅、经济高效的解决方案,以提供准确和稳定的定位。其开发了一系列超稳定纳米位移平台,用于多种应用,与市场上已有的产品相比具有显著优势。它的硅基传感器技术提供了这样的优势,该技术优于高端电容传感器与金属传感器。通过简单而高效的柔性设计和超低噪声电子器件,PIEZOCONCEPT的压电平台提供皮米级稳定性和亚纳米级(或亚纳米弧度)噪声基底。
上海昊量光电作为PIEZOCONCEPT在中国大陆地区独代,为您提供专业的选型以及技术服务。对于PIEZOCONCEPT产品有兴趣或者任何问题,都欢迎通过电话、电子邮件或者微信与我们联系。
如果您对压电位移台有兴趣,请访问上海昊量光电的官方网页:
https://www.auniontech.com/details-661.html
欢迎继续关注上海昊量光电的各大媒体平台,我们将不定期推出各种产品介绍与技术新闻。
更多详情请联系昊量光电/欢迎直接联系昊量光电
关于昊量光电:
上海昊量光电设备有限公司是光电产品专业代理商,产品包括各类激光器、光电调制器、光学测量设备、光学元件等,涉及应用涵盖了材料加工、光通讯、生物医疗、科学研究、国防、量子光学、生物显微、物联传感、激光制造等;可为客户提供完整的设备安装,培训,硬件开发,软件开发,系统集成等服务。
您可以通过我们昊量光电的官方网站www.auniontech.com了解更多的产品信息,或直接来电咨询4006-888-532。
参考文献:
[1] Ando T , Uchihashi T , Kodera N ,et al.High-speed AFM and nano-visualization of biomolecular processes[J].Pflügers Archiv European Journal of Physiology, 2008.DOI:10.1007/s00424-007-0406-0.
[2] Hansma H G , Magdalena B , Frederic Z ,et al.Atomic force microscopy of DNA in aqueous solutions.[J].Nucleic Acids Research, 1993(3):505-512.DOI:10.1093/nar/21.3.505.
[3] Keir,C,Neuman,et al.Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy.[J].Nature Methods, 2008.DOI:10.1038/nmeth.1218.
[4] Li L , Huang H L , Badilla C L ,et al.Mechanical unfolding intermediates observed by single-molecule force spectroscopy in a fibronectin type III module.[J].Journal of Molecular Biology, 2005, 345(4):817-826.DOI:10.1016/j.jmb.2004.11.021.
[5] Liu Y , Wang Z , Wang X .AFM-based study of fullerenol (C60(OH)24)-induced changes of elasticity in living SMCC-7721 cells[J].J Mech Behav Biomed Mater, 2015, 45:65-74.DOI:10.1016/j.jmbbm.2014.12.011.
[6] High-Speed Atomic Force Microscopy Reveals the Nucleosome Sliding and DNA Unwrapping/Wrapping Dynamics of Tail-less Nucleosomes[J].Nano Letters, 2024, 24(17):5246-5254.DOI:10.1021/acs.nanolett.4c00801.
[7] Fantner GE,Barbero,et al.Imaging Bacterial Cell Death Induced by Antimicrobial Peptides in Real Time Using High Speed AFM[J].Microscopy & Microanalysis, 2010.DOI:10.1017/s1431927610062422.
[8] J,Hu,Y,et al.Nanomanipulation of single DNA molecules and its applications[J].Surface & Interface Analysis, 2004.DOI:10.1002/sia.1666.
[9] Iwata F , Mizuguchi Y , Ko H ,et al.Nanomanipulation of biological samples using a compact atomic force microscope under scanning electron microscope observation[J].Journal of Electron Microscopy, 2011, 60(6):359.DOI:10.1093/jmicro/dfr070.
[10] Hugel T , Seitz M .The Study of Molecular Interactions by AFM Force Spectroscopy.[J].ChemInform, 2002, 33.DOI:10.1002/CHIN.200207299.
[11] Bo-Hyun Kim, Nicholas Y. Palermo, Sndor Lovas, Tatiana Zaikova, John F. W. Keana, and Yuri L. Lyubchenko.Single-molecule atomic force microscopy force spectroscopy study of Aβ-40 interactions.[J].Biochemistry, 2011, 50(23):5154-62.DOI:10.1021/bi200147a.